Gaceta Parlamentaria, año XVI, número 3708-II, jueves 14 de febrero de 2013




|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gaceta Parlamentaria, año XVI, número 3708-II, jueves 14 de febrero de 2013
De la Comisión de Salud, con proyecto de decreto que reforma el tercer párrafo del artículo 225 y adiciona el 225 Bis a la Ley General de Salud
Honorable Asamblea:
La Comisión de Salud de la LXII Legislatura de la Cámara de Diputados del Congreso de la Unión, con fundamento en lo dispuesto en los artículos 39 y 45, numerales 6, incisos e) y f), y 7, y demás relativos de la Ley Orgánica del Congreso General de los Estados Unidos Mexicanos; y 80, 82, numeral 1, 85, 157, numeral 1, fracción I, y 158, numeral 1, fracción IV, del Reglamento de la Cámara de Diputados y demás relativos de dicho ordenamiento, presenta el siguiente dictamen:
I. Antecedentes
1. Con fecha 8 de marzo de 2012, el diputado Carlos Alberto Ezeta Salcedo, del Partido Verde Ecologista de México, y suscrita por integrantes de diversos grupos parlamentarios, presentó iniciativa con proyecto de decreto que reforma el artículo 225 y adiciona el 225 Bis a la Ley General de Salud.
2. Con la misma fecha, la Presidencia de la Mesa Directiva dispuso que dicha iniciativa fuera turnada a la Comisión de Salud para análisis y dictamen correspondientes.
3. Según establece el acuerdo relativo a los dictámenes en poder de la Mesa Directiva que no llegó a resolver el pleno de la LXI Legislatura, con fecha del 20 de noviembre de 2012, la Mesa Directiva turna el asunto a la Comisión de Salud para emitir dictamen.
II. Metodología
La Comisión de Salud, encargada del análisis y dictamen de la iniciativa en comento, desarrolló los trabajos correspondientes conforme al procedimiento que a continuación se describe:
En el apartado “Antecedentes” se da constancia del trámite de inicio del proceso legislativo, así como de la recepción y turno para el dictamen de la iniciativa.
En el apartado “Contenido de la iniciativa”, se exponen los objetivos y se hace una descripción de la iniciativa, en la que se resumen su contenido, motivos y alcances.
En “Consideraciones”, los integrantes de la comisión dictaminadora expresan los razonamientos y argumentos por cada una de las adiciones planteadas, con base en los cuales se sustenta el sentido del presente dictamen.
III. Contenido de la iniciativa
Incluir en la prescripción de medicamentos, en el caso de que se trate de los incluidos en el catálogo de medicamentos genéricos intercambiables de insumos para la salud, la denominación genérica y, si lo desea, podrá indicar la denominación distintiva de su preferencia; y en el caso de los que no estén incluidos en el catálogo de medicamentos genéricos intercambiables de insumos para la salud, podrá indistintamente expresar la denominación distintiva o con las denominaciones genérica y distintiva. La venta o el suministro del medicamento deberán ajustarse a la elección que realice el paciente con base en la denominación genérica del medicamento que le hubiere sido prescrito.
IV. Consideraciones
Primera. La Constitución Política de los Estados Unidos Mexicanos consagra el derecho a la salud en el párrafo tercero del artículo 4o.:
Toda persona tiene derecho a la protección de la salud... y establecerá la concurrencia de la federación y las entidades federativas en materia de salubridad general, conforme a lo que dispone la fracción XVI del artículo 73 de esta Constitución.
Del precepto mencionado deriva el sistema de normas jurídicas de derecho social que busca regular los mecanismos y las acciones para lograr que la protección de la salud sea un bien tutelado por los diversos órdenes de gobierno, a través de la delimitación del campo de la actividad gubernamental, social e individual, siendo ésta uno de los principales elementos de justicia social.
El derecho a la protección de la salud es social y universal, independiente de la situación de vulnerabilidad de sus destinatarios ya que, además, es un elemento esencial para que el Estado pueda sentar las bases para eliminar la desigualdad existente entre los miembros de una sociedad.
En la exposición de motivos de la reforma mediante la cual se elevó en 1983 a jerarquía constitucional el derecho a la protección de la salud se considera éste como una responsabilidad compartida entre los diversos órdenes de gobierno, el individuo y la sociedad en su conjunto.
Segunda. Los medicamentos, como bienes de salud, constituyen el recurso médico y terapéutico más frecuentemente utilizado para recuperar la salud. Asimismo, no son un bien común y corriente; en diversas ocasiones, la calidad de vida de un enfermo depende de poder conseguirlos. En México, el mercado farmacéutico ofrece opciones para tener acceso tanto a medicamentos innovadores como genéricos, en ambos casos, de calidad, con diferencias en los precios para que el consumidor pueda elegir, de acuerdo con su capacidad económica, entre diversos productos.
En el país hay un catálogo de medicamentos genéricos intercambiables que, respecto al medicamento innovador o producto de referencia, tienen la misma sustancia activa y forma farmacéutica, con igual concentración o potencia, utilizan la misma vía de administración y con especificaciones farmacopeicas iguales o comparables.
Además, han cumplido las pruebas determinadas por el Consejo de Salubridad General y la Secretaría de Salud, han comprobado que sus perfiles de disolución o su biodisponibilidad u otros parámetros, según el caso, son equivalentes a los del medicamento innovador o producto de referencia, y están incluidos en el cuadro básico de insumos para el primer nivel y en el catálogo de insumos para el segundo y tercer niveles.
Tercera. En la exposición de motivos, el promovente menciona que en el país hay 35.4 millones de personas pobres, sin acceso a los servicios de salud, de acuerdo con la medición multidimensional de la pobreza de 2010 realizada por el Consejo Nacional de Evaluación de la Política de Desarrollo Social. Si a ello se añade el costo de las consultas médicas y por surtir las recetas, estas personas no tienen la posibilidad de asistir al médico cuando enferman ni de adquirir medicamentos.
Con el propósito de garantizar el acceso a los medicamentos de distintos precios a las personas, es necesario modificar las disposiciones legales para que se permita a los pacientes, previa prescripción médica de la sustancia activa, elegir y decidir, con base en su poder adquisitivo, entre las denominaciones distintivas que reciba el medicamento que contenga la misma sustancia activa que le hubiere sido recetada. También, será obligación del médico que prescriba uno o varios medicamentos anotar la denominación genérica (cuando se trate de los incluidos en el catálogo de medicamentos genéricos intercambiables a que hace referencia el Reglamento de Insumos para la Salud) y, si lo desea, podrá indicar la denominación distintiva de su preferencia.
El Estado debe garantizar la libre competencia, evitando la concesión de ventajas indebidas a favor de una o varias personas determinadas y con perjuicio del público en general o de alguna clase social; es decir, debe procurar el bienestar del interés colectivo de los consumidores y la equidad entre competidores.
Cuarta. No hay justificación científica para que, al momento de que se prescriban medicamentos, prevalezca la denominación distintiva de un medicamento sobre la genérica de la sustancia activa, siempre que los medicamentos genéricos cumplan lo establecido en el Reglamento de Insumos para la Salud.
El artículo 31 del Reglamento de Insumos para la Salud menciona lo siguiente:
Artículo 31. El emisor de la receta prescribirá los medicamentos de conformidad con lo siguiente:
I. Cuando se trate de los incluidos en el catálogo de medicamentos genéricos intercambiables a que hace referencia el artículo 75 de este ordenamiento, deberá anotar la denominación genérica y, si lo desea, podrá indicar la denominación distintiva de su preferencia; y
II. En caso de los que no estén incluidos en el catálogo referido en la fracción anterior, podrá indistintamente expresar la denominación distintiva o conjuntamente las denominaciones genérica y distintiva.
Quinta. El artículo 79 de dicho reglamento menciona lo siguiente:
Artículo 79. La venta o suministro de medicamentos genéricos intercambiables deberá ser resultado de que el interesado seleccione el que más le convenga al consultar el catálogo de medicamentos genéricos intercambiables, que deberá poner a su disposición el expendedor de la farmacia. En caso de que el medicamento prescrito no esté disponible, sólo podrá sustituirse cuando así lo autorice quien lo prescribe.
Sexta. Con base en las dos consideraciones anteriores, esta dictaminadora estima que la Ley General de Salud, ley primaria en materia de salud, debe ir de acuerdo con el Reglamento de Insumos para la Salud, a fin de que se cubra el vacío legal respecto a los medicamentos genéricos, y así las personas que no tienen acceso a los servicios de salud debido a sus limitaciones económicas, en específico a los medicamentos, los puedan adquirir con más facilidad.
Séptima. Los integrantes de esta comisión consideran que la iniciativa en cuestión es viable debido a que, al poner como obligación en la Ley General de Salud que se prescriban en las recetas la denominación genérica, primero, y la distintiva de su preferencia también, las personas que no tienen acceso a los medicamentos por su elevado costo puedan elegir el medicamento de acuerdo con su preferencia y capacidad económica, siempre que éste se encuentre referido en el catálogo de medicamentos genéricos intercambiables.
Por lo expuesto y para los efectos de lo dispuesto en el artículo 72, fracción A, de la Constitución Política de los Estados Unidos Mexicanos, los integrantes de Comisión de Salud de la LXII Legislatura someten a consideración del pleno el siguiente proyecto de
Decreto que reforma el tercer párrafo del artículo 225 y adiciona el 225 Bis a la Ley General de Salud
Artículo Único. Se reforma el párrafo tercero del artículo 225 y se adiciona el 225 Bis a la Ley General de Salud, para quedar como sigue:
Artículo 225. ...
...
Las disposiciones reglamentarias determinarán la forma en que las denominaciones señaladas deberán usarse en la publicidad, etiquetado y en cualquier otra referencia.
Artículo 225 Bis. En relación con la prescripción de medicamentos, el emisor de la receta prescribirá los medicamentos de conformidad con lo siguiente:
Cuando se trate de los incluidos en el catálogo de medicamentos genéricos intercambiables a que hace referencia el Reglamento de Insumos para la Salud, deberá anotar la denominación genérica y, si lo desea, podrá indicar la denominación distintiva de su preferencia. La venta o suministro del medicamento deberá ajustarse a la elección que realice el paciente con base en la denominación genérica del medicamento que le hubiere sido prescrito.
En caso de los que no estén incluidos en el catálogo referido en la fracción anterior, podrá indistintamente expresar la denominación distintiva o conjuntamente las denominaciones genérica y distintiva.
Transitorio
Único. El presente decreto entrará en vigor el día siguiente al de su publicación en el Diario Oficial de la Federación.
Palacio Legislativo, a 12 de diciembre de 2012.
La Comisión de Salud
Diputados: Isaías Cortés Berumen (rúbrica), presidente; Leobardo Alcalá Padilla, Francisco Javier Fernández Clamont (rúbrica), María de las Nieves García Fernández (rúbrica), Rosalba Gualito Castañeda (rúbrica), Alma Marina Vitela Rodríguez (rúbrica), Mario Alberto Dávila Delgado (rúbrica), Eva Diego Cruz (rúbrica), Antonio Sansores Sastré, Carla Alicia Padilla Ramos (rúbrica), secretarios; Miguel Ángel Aguayo López (rúbrica), Alliet Mariana Bautista Bravo, José Enrique Doger Guerrero, Rubén Benjamín Félix Hays (rúbrica), Guadalupe Socorro Flores Salazar (rúbrica), Lizbeth Loy Gamboa Song (rúbrica), Héctor García García (rúbrica), Blanca Jiménez Castillo (rúbrica), Raquel Jiménez Cerrillo, Virginia Victoria Martínez Gutiérrez (rúbrica), María del Carmen Martínez Santillán (rúbrica), Martha Lucía Mícher Camarena (rúbrica), Ernesto Núñez Aguilar, Marcelina Orta Coronado (rúbrica), Guadalupe del Socorro Ortega Pacheco (rúbrica), Leslie Pantoja Hernández (rúbrica), Zita Beatriz Pazzi Maza, Ernesto Alfonso Robledo Leal, Jessica Salazar Trejo, Juan Ignacio Samperio Montaño.
De la Comisión de Salud, con proyecto de decreto que adiciona el artículo 342 Bis 3 a la Ley General de Salud
Honorable Asamblea:
La Comisión de Salud de la LXII Legislatura de la Cámara de Diputados del honorable Congreso de la Unión, con fundamento en lo dispuesto por los artículos 39 y 45 numerales 6 incisos e) y f) y 7 y demás relativos de la Ley Orgánica del Congreso General de los Estados Unidos Mexicanos, y 80, 82 numeral 1, 85, 157 numeral 1 fracción I y 158 numeral 1 fracción IV del Reglamento de la Cámara de Diputados y demás relativos de dicho ordenamiento, presentan el siguiente
Dictamen
I. Antecedentes
1. Con fecha 29 de marzo de 2012, el diputado Antonio Benítez Lucho, integrante del Grupo Parlamentario del partido revolucionario institucional, presentó iniciativa con proyecto de decreto que adiciona un artículo 327 Bis de la Ley General de Salud.
2. Con la misma fecha, la Presidencia de la Mesa Directiva dispuso que dicha Iniciativa fuera turnada a la Comisión de Salud para su análisis y Dictamen correspondiente.
3. Según establece el Acuerdo relativo a los dictámenes en poder de la Mesa Directiva que no llegó a resolver el Pleno de la LXI Legislatura, con fecha del 20 de Noviembre de 2012, la Mesa Directiva turna el asunto a la Comisión de Salud para emitir dictamen.
I. Metodología
La Comisión de Salud encargada del análisis y dictamen de la iniciativa en comento, desarrollaron los trabajos correspondientes conforme al procedimiento que a continuación se describe:
En el apartado denominado “Antecedentes”, se da constancia del trámite de inicio del proceso legislativo, así como de la recepción y turno para el dictamen de la iniciativa.
En el apartado “Contenido de la iniciativa”, se exponen los objetivos y se hace una descripción de la iniciativa en la que se resume su contenido, motivos y alcances.
En las “Consideraciones”, los integrantes de la comisión dictaminadora expresan los razonamientos y argumentos por cada una de las adiciones planteadas, con base en los cuales se sustenta el sentido del presente dictamen.
III. Contenido de la iniciativa
Establecer que para el caso del plasma recuperado y el obtenido por plasmaféresis –que será utilizado exclusivamente para su fraccionamiento y obtención de productos terapéuticos hemoderivados– las instituciones y bancos de sangre del sector salud y bancos de sangre privados podrán celebrar convenios con los laboratorios farmacéuticos para el procesamiento del plasma humano y obtención de productos terapéuticos hemoderivados, bajo las siguientes modalidades: Contrato de procesamiento industrial, Contrato en especie y Contrato de disposición de excedentes.
IV. Consideraciones
Primera. Nuestra Constitución Política de los Estados Unidos Mexicanos consagra el derecho a la salud en su párrafo tercero del artículo 4o.:
“Toda persona tiene derecho a la protección de la salud.... y establecerá la concurrencia de la federación y las entidades federativas en materia de salubridad general, conforme a lo que dispone la fracción XVI del artículo 73 de esta Constitución”.
Del precepto antes mencionado deriva el sistema de normas jurídicas de derecho social, que busca regular los mecanismos y acciones para lograr que la protección de la salud sea un bien tutelado por los diversos órdenes de gobierno, a través de la delimitación del campo de la actividad gubernamental, social e individual, siendo ésta uno de los principales elementos de justicia social.
El derecho a la protección de la salud, es un derecho social y universal, independiente de la situación de vulnerabilidad de sus destinatarios, ya que, además, es un elemento esencial para que el Estado pueda sentar las bases para eliminar la desigualdad existente entre los miembros de una sociedad.
En la exposición de motivos de la reforma mediante la cual se elevó en 1983 a rango constitucional el derecho a la protección de la salud, se considera a éste como una responsabilidad compartida entre los diversos órdenes de gobierno, el individuo y la sociedad en su conjunto.
Segunda. Los productos sanguíneos es un término genérico empleado para designar los diversos preparados de la sangre que tienen utilidad terapéutica, y que incluyen las unidades de sangre total, de sus componentes y mezclas de estos. Uno de estos productos es el plasma, el cual es un componente específico separado de las células de la sangre. A su vez, los hemoderivados son los productos obtenidos a raíz de la sangre mediante procesos industriales para aplicación terapéutica, diagnóstica, preventiva o en investigación.
A partir de 1992, una parte del plasma proveniente de donadores voluntarios era colectado por el CNTS y se fraccionaba en México en la planta de la empresa Probifasa, llegando a procesarse en el año 2001, 162 mil 938 unidades de plasma, lo que le redituó al sector salud un ahorro de aproximadamente 125 millones de pesos, además de tener disponibles los productos terapéuticos hemoderivados para el tratamiento de los derechohabientes que lo requirieron.
Puede afirmarse que fraccionar en México el plasma de donadores voluntarios que ha sido correctamente tamizado por las pruebas para la detección del VIH, hepatitis B y C, enfermedad de Chagas, sífilis y otras infecciones, permite garantizar la calidad de la materia prima y por tanto la seguridad de los productos terapéuticos hemoderivados que los pacientes mexicanos consuman.
Tercera. Dentro de la exposición de motivos, el promovente hace mención a que aproximadamente el 42 por ciento de las unidades de plasma colectadas son utilizadas para transfusión, 48 por ciento son destruidas por incineración, 5 por ciento se almacena y solamente el 5 por ciento es industrializado, lo cual representa una pérdida económica para el sector salud, el desaprovechamiento del plasma de los voluntarios y la falta de disponibilidad de los productos terapéuticos hemoderivados.
Es necesario para México y los derechohabientes del sector salud y privados, desarrollar un programa que permita que se procese industrialmente la mayor parte del plasma nacional que hoy se obtiene de las donaciones voluntarias, para generar los productos terapéuticos hemoderivados de mayor consumo nacional, como albúmina, factor VIII, factor IX y gamma globulinas, que provengan de materia prima 100 por ciento segura, como lo es el plasma colectado en nuestro país.
Cuarta. El artículo 327 de la Ley General de Salud establece lo siguiente con respecto a los principios que deben seguirse en la donación de órganos y otras especies:
Artículo 327. Está prohibido el comercio de órganos, tejidos y células. La donación de éstos con fines de trasplantes se regirá por principios de altruismo, ausencia de ánimo de lucro y confidencialidad, por lo que su obtención y utilización serán estrictamente a título gratuito.
La interpretación equivocada de estos artículos de la Ley General de Salud, argumenta el promovente, ha permitido que desde hace 18 años no exista en México una legislación clara respecto al aprovechamiento de las donaciones altruistas que rutinariamente captan los bancos de sangre para la obtención de productos terapéuticos hemoderivados, indispensables e insustituibles para el tratamiento de padecimientos muy específicos como la hemofilia.
Actualmente los excedentes de sangre y plasma colectados por los bancos de sangre son destruidos por incineración, lo cual tiene un costo intrínseco al no ser aprovechados eficientemente y además contaminan el ambiente al despedir gases a la atmósfera. Los productos terapéuticos hemoderivados tienen un precio de venta muy elevado que actualmente eroga el sector salud (SSA, IMSS, ISSSTE) y por falta de presupuesto ocasiona un desabasto que puede ser mortal para los derechohabientes usuarios de dichos productos.
Quinta. A raíz de lo anterior, la adición de este artículo a la Ley General de Salud es necesaria ya que se podrán establecer convenios entre las instituciones y bancos de sangre, con las empresas farmacéuticas que procesen la sangre excedente no utilizada para administración transfusional, que evitarán la destrucción de excedentes y las instituciones gubernamentales tendrán garantizado el abasto necesario para cubrir sus necesidades, sin erogar dinero de su presupuesto de compras.
Sexta. En el mismo tenor, la Ley General de Salud debe estar en concordancia con las normas oficiales mexicanas, por lo que en el tema de la disposición del plasma, de acuerdo con lo expuesto con el promovente, debe adecuarse a lo que establece el PROY-NOM-253-SSA1-2009, muy próximo a publicarse en el DOF, y que establece lo siguiente:
Proyecto de modificación de la Norma Oficial Mexicana NOM-003-SSA2-1993, “Para la disposición de sangre humana y sus componentes con fines terapéuticos”, para quedar como proyecto de Norma Oficial Mexicana PROY-NOM-253-SSA1-2009, “Para la disposición de sangre humana y sus componentes con fines terapéuticos”
8.6. Plasma y crioprecipitados.
8.6.1.3. La vigencia que deberá asignarse a las unidades de plasma y crioprecipitados se indica la tabla 24 de esta Norma, siempre y cuando se mantengan constantemente a las temperaturas que señala la misma tabla. El periodo de vigencia de las unidades de plasma y los crioprecipitados se cuenta a partir de la extracción de la sangre o de la plasmaféresis. El periodo de vigencia del plasma desprovisto de factores lábiles se cuenta a partir del evento que lo hace considerarlo como tal.
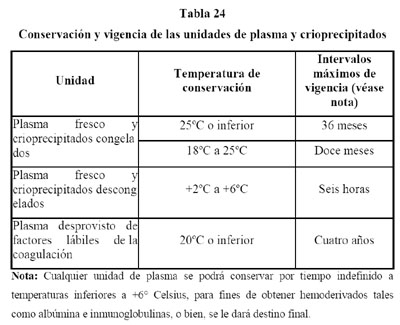
8.6.2. Plasma.
8.6.2.1. La utilidad más importante del plasma es en el procesamiento de unidades, entre otras, preparación de crioprecipitados y reconstitución de componentes sanguíneos celulares. El uso transfusional es limitado. Cuando está adecuadamente prescrito, aproximadamente el 12 por ciento de la producción de plasma tiene indicación terapéutica.
Los plasmas residuales, preferentemente frescos, se podrán utilizar para la elaboración de hemoderivados.
8.6.2.2. El plasma se podrá obtener por fraccionamiento de sangre fresca de una donación única o mediante aféresis automatizada.
16. Destino final de las unidades de sangre, componentes sanguíneos y de las muestras
16.3. El plasma y otros componentes sanguíneos que no fueran a utilizarse con fines transfusionales, podrán utilizarse para fines diagnósticos o de investigación, o bien, destinarse para la fabricación de hemoderivados y otros productos biotecnológicos de aplicación terapéutica, diagnóstica, preventiva o en investigación.
16.4. El plasma que vaya a destinarse para la fabricación de hemoderivados deberá reunir los requisitos de calidad necesarios a fin de que resulten inocuos, no patogénicos y las fracciones que se pretendan separar deberán ser funcionales, de conformidad con las disposiciones aplicables.
Séptima. Esta Dictaminadora considera que la iniciativa es viable pero con las siguientes modificaciones:
1. Con respecto a la adición de un artículo 327 Bis, se considera que el contenido de la propuesta está mejor justificado si se hace adicionando un artículo 342 Bis 3 , ya que al hablar éste sobre la utilización del plasma residual, la Ley General de Salud hacer referencia a dicho método de manera explícita en los artículos 342 Bis 1 y 342 Bis 2, lo cuales se transcriben a continuación:
Artículo 342 Bis 1. El plasma residual podrá destinarse a procedimientos de fraccionamiento para obtener hemoderivados. Tanto los establecimientos de salud que suministren el plasma residual, como los establecimientos que lo reciban para elaborar hemoderivados, deberán estar autorizados conforme a los artículos 198 fracción I y 315 de esta Ley. Asimismo, se sujetarán a las disposiciones que dicte la Secretaría de Salud.
Las disposiciones que emita la Secretaría de Salud contemplarán, al menos, los mecanismos de aprovechamiento, procesamiento o utilización bajo condiciones que garanticen calidad, seguridad y eficacia.
Artículo 342 Bis 2. La Secretaría de Salud establecerá las disposiciones aplicables para regular la disposición y procesamiento de los tejidos y el plasma residual referidos en los artículos 342 Bis y 342 Bis 1 de esta Ley, a fin de garantizar la trazabilidad en cuanto a origen y destino de los mismos. Asimismo, establecerá los mecanismos para promover la accesibilidad a los hemoderivados del plasma residual y de los insumos para la salud a que se refiere el artículo 342 Bis, en condiciones de equidad y seguridad en beneficio para la salud pública.
Al hacer este cambio, y al ser la plasmaféresis un “procedimiento de fraccionamiento para obtener hemoderivados” de igual manera se especifican los requerimientos de seguridad sanitaria con que deben cumplir los bancos de sangre que realicen este método.
2. En el mismo tenor, para que la adición propuesta vaya de acuerdo con los dos artículos mencionados de la Ley General de Salud, esta Dictaminadora considera que se haga referencia al plasma como “plasma residual”.
3. Con respecto a la fracción 3 propuesta en el artículo adicionado, en donde se hace referencia al PROY-NOM-253-SSA1-2009, es necesario mencionar que de acuerdo con la normatividad mexicana, un Proyecto de Norma Oficial Mexicana, de acuerdo con lo establecido en el artículo 47 de la Ley Federal sobre Metrología y Normalización, es publicado en el Diario Oficial de la Federación a efecto de que los interesados presenten sus cometarios al comité consultivo nacional de normalización correspondiente. Por lo tanto, el Proyecto tiene carácter transitorio en lo que se define de manera completa la Norma Oficial Mexicana. Tomando en cuenta lo anterior, el PROY-NOM-253-SSA1-2009 dejaría de existir una vez que se formule la Norma correspondiente, por lo que lo propuesto en la iniciativa perdería validez a pesar de que aquél esté próximo a publicarse en el Diario Oficial de la Federación. Entonces, esta Dictaminadora considera que se debe eliminar la referencia al mencionado Proyecto.

Octava. Los integrantes de esta Comisión consideran que la iniciativa es viable con las modificaciones propuestas, ya que se hace necesario introducir una adecuación en la LGS, a fin de garantizar que las donaciones altruistas de sangre, sean aprovechadas total y eficientemente en los bancos de sangre del territorio nacional, evitando totalmente la destrucción por incineración de la gran cantidad de plasma no utilizado en los hospitales.
Por lo expuesto y para los efectos de lo dispuesto en el artículo 72, fracción A, de la Constitución Política de los Estados Unidos Mexicanos, los integrantes de Comisión de Salud de la LXII Legislatura sometemos a consideración del pleno el siguiente
Proyecto de decreto que adiciona un artículo 342 bis 3 a la Ley General De Salud
Artículo Único. Se adiciona un artículo 342 Bis 3 a la Ley General de Salud, para quedar como sigue:
Artículo 342 Bis 3. Para el caso del plasma residual recuperado y el obtenido por plasmaféresis –que será utilizado exclusivamente para su fraccionamiento y obtención de productos terapéuticos hemoderivados– las instituciones y bancos de sangre del sector salud y bancos de sangre privados podrán celebrar convenios con los laboratorios farmacéuticos para el procesamiento del plasma residual humano y obtención de productos terapéuticos hemoderivados, bajo las siguientes modalidades:
1. Contrato industrial (maquila), en el cual la institución de salud proporciona el plasma residual al laboratorio farmacéutico, pagando el costo de su procesamiento y todos los productos obtenidos son propiedad de la institución.
2. Contrato en especie, en el cual la institución de salud proporciona el plasma residual al laboratorio farmacéutico para su procesamiento, especificando en el contrato qué porcentaje de todos los productos obtenidos será propiedad de cada una de las partes.
3. Contrato de disposición de excedentes, en el cual la institución de salud fija una contraprestación al plasma residual que exceda del 12 por ciento para uso hospitalario, conviniendo entregas periódicas del plasma residual excedente con el laboratorio farmacéutico, por el tiempo y condiciones definidas en el contrato.
Transitorios
Primero. El presente Decreto entrará en vigor el día siguiente al de su publicación en el Diario oficial de la Federación.
Segundo. La autoridad sanitaria tendrá 90 días naturales para expedir los lineamientos y criterios aplicables.
Palacio Legislativo, a los 12 días del mes de diciembre del 2012.
La Comisión de Salud
Diputados: Isaías Cortés Berumen (rúbrica), presidente; Leobardo Alcalá Padilla (rúbrica), Francisco Javier Fernández Clamont (rúbrica), María de las Nieves García Fernández (rúbrica), Rosalba Gualito Castañeda (rúbrica), Alma Marina Vitela Rodríguez (rúbrica), Mario Alberto Dávila Delgado (rúbrica), Eva Diego Cruz (rúbrica), Antonio Sansores Sastré, Carla Alicia Padilla Ramos (rúbrica), secretarios; Miguel Ángel Aguayo López (rúbrica), Alliet Mariana Bautista Bravo, José Enrique Doger Guerrero, Rubén Benjamín Félix Hays (rúbrica), Guadalupe Socorro Flores Salazar, Lizbeth Loy Gamboa Song (rúbrica), Héctor García García (rúbrica), Blanca Jiménez Castillo (rúbrica), Raquel Jiménez Cerrillo, Virginia Victoria Martínez Gutiérrez (rúbrica), María del Carmen Martínez Santillán (rúbrica), Martha Lucía Mícher Camarena (rúbrica), Ernesto Núñez Aguilar, Marcelina Orta Coronado (rúbrica), Guadalupe del Socorro Ortega Pacheco (rúbrica), Leslie Pantoja Hernández (rúbrica), Zita Beatriz Pazzi Maza (rúbrica), Ernesto Alfonso Robledo Leal, Jéssica Salazar Trejo, Juan Ignacio Samperio Montaño.
De la Comisión de Ciencia y Tecnología, con proyecto de decreto que adiciona un último párrafo al artículo 5o. de la Ley de Ciencia y Tecnología
Honorable Asamblea:
A la Comisión de Ciencia y Tecnología de la LXII Legislatura le fue turnada para su estudio, análisis y dictamen correspondiente, la iniciativa con proyecto de decreto que reforma el artículo 5 de la Ley de Ciencia y Tecnología.
La Comisión de Ciencia y Tecnología de la honorable Cámara de Diputados de la LXII Legislatura, de conformidad con lo dispuesto en los artículos 39 y 45, numeral 6, incisos e), f) y g) de la Ley Orgánica del Congreso General de los Estados Unidos Mexicanos; así como los artículos 80, 82, numeral 1, 85, 157 numeral 1 fracción I, 158 numeral 1 fracción IV, 176, 182 numeral 1 y 4, y demás relativos del Reglamento de la Cámara de Diputados, presenta a consideración esta soberanía el siguiente dictamen.
I. Antecedentes
1. En sesión plenaria celebrada el 21 de febrero de 2012 por la Cámara de Diputados del honorable Congreso de la Unión, la diputada Cora Cecilia Pinedo Alonso, integrante del Grupo Parlamentario de Nueva Alianza presentó ante el pleno de esta soberanía, la iniciativa con proyecto de decreto por el que adiciona un último párrafo al artículo 5 de la Ley de Ciencia y Tecnología.
2. El 22 de Febrero de 2012, la Presidenta de la Mesa Directiva de la Cámara de Diputados turnó la iniciativa en comento a la Comisión de Ciencia y Tecnología, para el estudio, análisis, y elaboración del dictamen correspondiente.
3. El 20 de noviembre de 2012, por cambio de legislatura y acuerdo relativo a los dictámenes en poder de la Mesa Directiva que no se llegaron a resolver en el pleno de la LXI Legislatura, se devolvió a esta comisión para revisión.
4. El 15 de enero de 2013 esta comisión solicitó prórroga para realizar el proceso de dictamen.
5. El 18 de enero de 2013 la Mesa Directiva notificó la autorización de la ampliación de turno de este asunto para dictamen.
II. Contenido de la iniciativa
La iniciativa de la diputada Cora Cecilia Pinedo Alonso, integrante del Grupo Parlamentario de Nueva Alianza, propone adicionar un último párrafo al artículo 5 de la Ley de Ciencia y Tecnología con objeto de incorporar la figura de la suplencia por ausencia en el presidente de la Republica y los nueve secretarios de Estado que forman parte del Consejo General de Investigación Científica, Desarrollo Tecnológico e Innovación.
Establecidos los antecedentes y el contenido de la iniciativa, los miembros de la Comisión de Ciencia y Tecnología de la LXII Legislatura de la Cámara de Diputados que suscriben el presente dictamen, exponemos las siguientes:
III. Consideraciones
Consideraciones del dictamen de la Comisión de Ciencia y Tecnología elaborado el 28 de marzo de 2012:
Primera. A partir de reconocer lo avances en materia de ciencia, tecnología e innovación, derivado de la expedición de la nueva Ley de Ciencia y Tecnología en el año 2002, la creación del Consejo General de Investigación Científica, Desarrollo Tecnológico e Innovación y el Foro Consultivo Científico y Tecnológico, la ampliación de atribuciones al Consejo Nacional de Ciencia y Tecnología, sumado a la reforma de 2009 que incorpora el Programa Especial de Ciencia, Tecnología e Innovación para la investigación científica, el desarrollo tecnológico y la innovación que apoyen al desarrollo nacional y la última en 2011, que establece que el programa citado incluirá una visión de largo plazo y proyección a 25 años, actualizándose cada 3, que coincidirá con el inicio de cada legislatura del Congreso de la Unión, se exponen los siguientes argumentos.”
Segunda. Dentro del artículo 6 de la Ley de Ciencia y Tecnología se establecen las facultades del Consejo General de Investigación Científica, Tecnológico e Innovación que son las siguientes:
I. Establecer en el Programa especial las Políticas Nacionales para el avance de la investigación científica, el desarrollo tecnológico y la innovación que apoyen el desarrollo nacional;
II. Aprobar y actualizar el Programa Especial de Ciencia, Tecnología e Innovación.
III. Definir prioridades y criterios para la asignación del gasto público federal en ciencia, tecnología e innovación, los cuales incluirán áreas estratégicas y programas específicos y prioritarios a los que se les deberá otorgar especial atención y apoyo presupuestal;
IV. Definir los lineamientos programáticos y presupuestales que deberán tomar en cuenta las dependencias y entidades de la administración pública federal para realizar actividades y apoyar la investigación científica, el desarrollo tecnológico y la innovación;
V. Aprobar el proyecto de presupuesto consolidado de ciencia tecnología e innovación que será incluido en los términos de las disposiciones aplicables, en el proyecto de Presupuesto de Egresos de la Federación y emitir anualmente un informe general acerca del estado que guarda la ciencia, la tecnología y la innovación en México, cuyo contenido deberá incluir la definición de áreas estratégicas y programas prioritarios; así como los aspectos financieros, resultados y logros obtenidos en este sector;
VI. Aprobar y formular propuestas de políticas y mecanismo de apoyo a la ciencia, la tecnología y la innovación en materia de estímulos fiscales y financieros, facilidades administrativas, de comercio exterior, metrología, normalización, evaluación de la conformidad y régimen de la propiedad intelectual;
VII. Definir esquemas generales de organización para la eficaz atención, coordinación y vinculación de las actividades de investigación, desarrollo tecnológico e innovación en los diferentes sectores de la administración pública federal y con los diversos sectores productivos y de servicio del país así como los mecanismos para impulsar la centralización de estas actividades;
VIII. Aprobar los criterios y estándares institucionales para la evaluación del ingreso y permanencia en la Red Nacional de Grupos y Centros de Investigación, así como para su clasificación y categorización a que se refiere el artículo 30 de la ley;
IX. Establecer un sistema independiente para la evaluación de la eficacia, resultados e impactos de los principios, programas e instrumentos de apoyo a la investigación científica, el desarrollo tecnológico e innovación;
X. Definir y aprobar los lineamientos generales del parque científico y tecnológico, espacio físico en que se aglutinara la infraestructura y equipamiento científico del más alto nivel, así como el conjunto de los proyectos prioritarios de la ciencia y la tecnología mexicana, y
XI. Realizar el seguimiento y conocer la evaluación general del programa especial, del programa y del presupuesto anual destinado a la ciencia, la tecnología y la innovación y de los demás instrumentos de apoyo a estas actividades.
Como se observa, el Consejo General contiene facultades trascendentes para el desarrollo de la ciencia tecnología e innovación entre ellas destaca la aprobación y actualización del Programa Especial de Ciencia Tecnología e Innovación, el cual contendrá las políticas nacionales para el avance de estas materias que apoyaran al desarrollo nacional, además de definir los lineamientos programáticos y presupuestales así como de prioridades y criterios para la asignación del gasto público federal.
Tercera. Por otra parte, el artículo 7 de la citada ley establece:
Articulo 7. El Consejo General sesionara dos veces al año en forma ordinaria y en forma extraordinaria cuando su presidente así lo determine, a propuesta del secretario ejecutivo. El Consejo General sesionara válidamente con la asistencia de por lo menos la mitad mas uno de sus miembros presentes teniendo el presidente voto de calidad para el caso de empate.
Resulta fundamental que el Consejo General sesione oportunamente con la periodicidad que le marca la ley, sin embargo, desde que la nueva ley entro en vigor en 2002, es evidente que la actual integración del Consejo General de Investigación Científica, Desarrollo Tecnológico e Innovación no ha resultado operativamente funcional.
Cuarta. Al respecto, la conformación del Consejo General se establece en el artículo 5 de la citada ley en el que establece:
Articulo 5. Se crea el Consejo General de Investigación Científica, Desarrollo Tecnológico e innovación, como órgano de política y coordinación que tendrá las facultades que establece esta ley. Serán miembros permanentes del Consejo General:
l. El presidente de la Republica, quien lo presidirá;
ll. Los titulares de las Secretarías de Relaciones Exteriores, de Hacienda y Crédito Público, de Medio Ambiente y Recursos Naturales, de Energía, de Economía, de Agricultura, Ganadería, Desarrollo Rural, Pesca, y Alimentación, de Comunicaciones y Transportes, de Educación Pública, y de Salud;
III. El director general del Conacyt, en su carácter de secretario ejecutivo del propio Consejo General;
IV. El coordinador general del Foro Consultivo Científico y Tecnológico;
V. El presidente de la Academia Mexica de Ciencias;
VI. Un representante de la Conferencia Nacional de Ciencia y Tecnología;
VII. Tres representantes del sector productivo que tengan cobertura y representatividad nacional, mismos que serán designados por el presidente de la Republica a propuesta del secretario de Economía, y se renovaran cada tres años;
VIII. Un representante del sistema de centros públicos de investigación, y
IX. El secretario general ejecutivo de la Asociación Nacional de Universidades e Instituciones de Educación Superior.
Asimismo, el Consejo General contará con la participación a título personal de dos miembros que se renovarán cada tres años y que serán invitados por el presidente de la Republica, a propuesta del secretario ejecutivo. Estos miembros tendrán derecho a voz y voto y podrán ser integrantes del sector científico y tecnológico. Para formular dichas propuestas, el Secretario Ejecutivo llevará a cabo un procedimiento de auscultación, conjuntamente con el Coordinador General del Foro Consultivo, de tal manera que cada una de dichas personas cuente con la trayectoria y méritos suficientes, además de ser representativos de los ámbitos científico o tecnológico.
El presidente de la Republica podrá invitar a participar a las sesiones del Consejo General a personalidades del ámbito científico, tecnológico y empresarial que puedan aportar conocimientos o experiencias a los temas de la agenda del propio Consejo General, quienes asistirán con voz pero sin voto.
Los miembros del Consejo General desempeñarán sus funciones de manera honorífica, por lo que no recibirán remuneración alguna por su participación en el mismo.
Del artículo antes citado, se desprende que el Consejo General se conforma de múltiples servidores públicos y personas reconocidas en materia, lo cual refleja la complicada tarea de coincidir en agendas y reunir a todos los integrantes dos veces al año en forma ordinaria, tal como lo marca el artículo 7 de la citada Ley; lo cual se complica por la imposibilidad de que asista algún representante por parte del Presidente de la República y los nueve Secretarios de Estado.
Lo anterior ha tenido como consecuencia que desde el inicio de la administración federal pasada, el Consejo General se reuniera por última vez desde el 26 de septiembre de 2008, fecha en la que se aprobó el Programa Especial de Ciencia y Tecnología e innovación 2008-2012, pero donde han pasado años sin volver a reunirse.
A fin de facilitar el cumplimiento cabal de lo previsto en el artículo 7°, respecto de las sesiones del Consejo General, resulta fundamental la incorporación de la figura jurídica de la Suplencia por Ausencia de los Servidores Públicos. Esto en aras del efectivo cumplimiento de las facultades que este órgano de política y coordinación conlleva en la ley.
Esta figura jurídica es de gran utilidad debido a la inexcusable continuidad que requiere la actividad del Consejo General y la imposibilidad de los servidores públicos titulares del órgano para ejercer la competencia de este, sin que por ello se menoscabe la competencia del titular en las funciones que corresponden al citado consejo.
Para ello, la legisladora Cora Pinedo fundamentó su propuesta en una jurisprudencia de la Sala Superior del Tribunal Federal de Justicia Fiscal Administrativa, publicada en la revista número 62 de febrero de 2006, en su página 206 que dice:
Suplencia por ausencia y delegación de facultades. Constituyen conceptos diferentes y, por ende no tienen las mismas consecuencias jurídicas. La suplencia tiene como propósito que las funciones de los órganos gubernamentales no se vean afectas por la ausencia del funcionario a quien la ley le otorga la facultad; de tal suerte que cuando un funcionario actúa en ausencia de otro, no invade la esfera de atribuciones del titular de la facultad, ya que únicamente lo substituye en su ausencia pues actuando en nombre del titular de la facultad no existe transmisión alguna de atribuciones por parte del titular de la misma favor de un funcionario diverso. En cambio, cuando una autoridad actúa en uso de sus facultades delegadas, lo hace en nombre propio con la atribución que le fue conseguida por el titular del acuerdo correspondiente, y no en sustitución de la autoridad que realizó la delegación. En tal virtud, debe concluirse que tratándose de la suplencia por ausencia, formalmente el acto se atribuye al titular y no a quien lo suscribe, en razón de que cuando el funcionario actúa sustituyendo al titular de las facultades como consecuencia de su ausencia se entiende que no actúa en nombre propio si no en el de la autoridad que sustituye. Por ello, es al sustituido a quien jurídicamente se pude imputar la responsabilidad de los actos que se cuestionan, por ser el autor de la misión de los actos y no de quien los firmó en suplencia por ausencia.
Para reafirmar lo fundamentado por la diputada Pinedo, el Poder Judicial de la Federación también se ha pronunciado al respecto en la Tesis Aislada l.4o.A.304 A publicada en el Semanario Judicial de la Federación de Abril de 1999 en su página 206, suscrita por el Cuarto Tribunal Colegiado en Materia Administrativa del Primer Circuito, cuya tesis dice lo siguiente:
Delegación de facultades y suplencia por ausencia. Distinción. Existe diferencia entre la delegación de facultades y la firma por ausencia, ya que mientras a través de la primera se transmiten las facultades de los titulares de las dependencias a favor de quienes las delegan facultades que son propias del delegante de conformidad con las disposiciones de las leyes orgánicas de las propias dependencias, la delegación requiere de la satisfacción de diferentes circunstancias para hacer legal, como son: a) que el delegante esté autorizado por la ley para llevarla a cabo, b) que no se trate de facultades exclusivas y c) que el acuerdo delegatorio se publique en los diarios oficiales. Cuando se está en este supuesto el servidor público que adquiere las facultades en virtud de este acto jurídico puede ejercerlas de acuerdo con su criterio y será directamente responsable del acto y de sus consecuencias. Ahora, por lo que respecta a la suplencia por ausencia, el funcionario suplente, en caso de ausencia del titular de las facultades legales, no sustituye en su voluntad o responsabilidad y es el sustituido a quien jurídicamente se le puede imputar la responsabilidad de los actos, porque es el autor de los que lleguen a emitirse y sólo en un afán de colaboración y coordinación administrativa que permita el necesario ejercicio de la función pública de manera ininterrumpida se justifica la labor de la suplencia, que se reduce a un apoyo instrumental que perfecciona y complementa el desarrollo de un acto emanado del suplido; así la miscelánea fiscal emitida por la Secretaría de Hacienda y Crédito Público debe atribuirse a su titular, ya que el subsecretario se limita a suscribir dicha resolución, pero esto no significa de modo alguno, que el subsecretario sea el creador intelectual y responsable de las reglas que forman la miscelánea fiscal. Por lo tanto, se reitera, para que opere la delegación de facultades es necesario un acuerdo del delegante en donde especifique las facultades que serán objeto de las mismas, acuerdo que deberá ser publicado en el Diario Oficial de la Federación, en tanto que la suplencia por ausencia es una figura que la ley contempla, pero que deja al reglamento interior de cada Secretaría determinar los casos en que operará y no necesita cumplir con la formalidad de la delegación, sino que basta mencionar que con ese carácter se está actuando y, desde luego, funde legalmente su actuación a través del precepto que lo faculte”.
Por su parte, el séptimo Tribunal Colegiado en Materia Administrativa del Primer Circuito, en su Tesis Aislada 1.7o.A.18 K publicada en el Semanario Judicial de la Federación de Agosto de 1999 en su página 753, estableció lo siguiente:
Facultad indelegable. Es una figura jurídica diversa a la suplencia por ausencia de un funcionario. Por la primera figura jurídica en cita debe atenderse la atribución conferida por la ley en forma exclusiva a cierto funcionario, por lo que en su ejercicio, el titular de la misma actúa en nombre propio; mientras que en la suplencia o representación de funcionario, el suplente actúa en nombre de aquel cuya facultad está ejerciendo, sin que implique que invada facultades reservadas exclusivamente al funcionario suplido, ya que la finalidad de la suplencia consiste en que las funciones de los órganos gubernamentales no se vean afectadas por la ausencia del funcionario a quien la ley le otorga la facultad indelegable; de tal suerte que cuando un funcionario actúa en ausencia de otro no invade la esfera de atribuciones del titular de la facultad indelegable, pues únicamente lo sustituye en su ausencia, actuando a nombre del titular de la facultad y no existe transmisión alguna de las atribuciones por parte del titular de la misma a favor de un funcionario diverso.
Como se desprende de las Jurisprudencias antes citadas, la figura jurídica de la suplencia por ausencia resulta de gran utilidad para que los servidores públicos puedan cumplir de manera adecuada sus funciones conferidas en la ley. Como lo establece la última Tesis Aislada, la finalidad de la suplencia es mantener la operatividad y funcionalidad de los órganos gubernamentales, es decir, que la ausencia de los funcionarios que lo integran no le afecten para estos fines.
Por último, como ya se ha confirmado, la Suplencia por Ausencia es de una figura que permite actuar a nombre y por cuenta del funcionario ausente y por tanto se atribuye el acto al servidor público que por causas de fuerza mayor no pudo asistir al cumplimiento que la Ley Orgánica de la Administración Pública Federal le establece en su artículo 16, el cual establece:
Artículo 16. Corresponde originalmente a los titulares de las Secretarías de Estado y Departamentos Administrativos el trámite y resolución de los asuntos de su competencia, pero para la mejor organización del trabajo podrán delegar en los funcionarios a que se refieren los artículos 14 y 15, cualesquiera de sus facultades, excepto aquellos que por disposición de la ley o del reglamento interior respectivo, deban ser ejercidas precisamente por dichos titulares. En los casos de que la delegación de facultades recaiga en jefes de oficina, de sección y de mesa de las Secretarías de Estado y Departamentos Administrativos, aquellos conservarán su calidad de trabajadores de base en los términos de la Ley Federal de los Trabajadores al Servicio del Estado.
Incluir la figura jurídica de la suplencia por ausencia en el Consejo General de Investigación Científica, Desarrollo Tecnológico e Innovación para el Presidente de la República y los Secretarios de Estado mencionados en las Fracciones I y II respectivamente del artículo 5 de la Ley de Ciencia y Tecnología permitirá alcanzar la operatividad y funcionamiento de sesionar dos veces al año en forma ordinaria y extraordinariamente cuando el presidente así lo determine a propuesta del secretario ejecutivo, como lo establece el artículo 7.
Esta comisión dictaminadora realizo un estudio acucioso y exhaustivo del proyecto de dictamen en cuestión y considera que es de aprobarse en sus términos, por encontrarlo debidamente fundado y motivado.
Por lo expuesto y fundado en las consideraciones anteriores, esta comisión aprueba la propuesta de adicionar un último párrafo al artículo 5 de la Ley de Ciencia y Tecnología contenida en la iniciativa materia del presente dictamen.
Con base en lo expuesto, los integrantes de la Comisión de Ciencia y Tecnología sometemos a consideración del pleno de la Cámara de Diputados del honorable Congreso de la Unión, el siguiente proyecto de
Decreto por el que se adiciona un último párrafo al artículo 5 de la Ley de Ciencia y Tecnología
Único. Se adiciona un último párrafo al artículo 5 de la Ley de Ciencia y Tecnología, para quedar como sigue:
Artículo 5.
...
I. a IX. ...
...
...
...
Tratándose del presidente de la República y de los titulares de las secretarías mencionadas en la fracción II, podrán designar a un suplente, quien deberá tener al menos el nivel de subsecretario o equivalente.
Transitorio
Único. El presente decreto entrará en vigor el día siguiente al de su publicación en el Diario Oficial de la Federación.
Palacio Legislativo de San Lázaro, a los 31 días de enero de 2013.
La Comisión de Ciencia y Tecnología
Diputados: Rubén Benjamín Félix Hays (rúbrica), presidente; Irazema González Martínez Olivares, Alejandro Rangel Segovia (rúbrica), Luis Miguel Ramírez Romero (rúbrica), Juan Pablo Adame Alemán (rúbrica), Marco Alonso Vela Reyes (rúbrica), Mónica García de la Fuente (rúbrica), Teresita de Jesús Borges Pasos (rúbrica), Andrés Eloy Martínez Rojas (rúbrica), secretarios; Consuelo Argüelles Loya (rúbrica), Alberto Coronado Quintanilla (rúbrica), Patricia Lugo Barriga (rúbrica), José Enrique Reina Lizárraga (rúbrica), Miguel Ángel Aguayo López, Salvador Barajas del Toro (rúbrica), Benito Caballero Garza (rúbrica), Minerva Castillo Rodríguez (rúbrica), Rosalba Gualito Castañeda (rúbrica), Gerardo Francisco Liceaga Arteaga (rúbrica), José Everardo Nava Gómez (rúbrica), Patricia Elena Retamoza Vega, Fernando Zamora Morales (rúbrica), Víctor Manuel Jorrín Lozano (rúbrica), Mario Miguel Carrillo Huerta (rúbrica), Marcelo Garza Ruvalcaba (rúbrica), Roberto López González (rúbrica), Crystal Tovar Aragón (rúbrica).